Podczas pandemii Covida rząd USA wydał miliardy dolarów na prawie 400 produktów przeznaczonych do ochrony, diagnozowania i leczenia setek milionów ludzi – wszystkie z etykietą „EUA” lub „zezwolenie na użycie w sytuacjach awaryjnych”.
Ale co właściwie oznacza EUA?
Jeszcze zanim odpowiemy na to pytanie i aby zrozumieć, gdzie EUA stoi w stosunku do innych ścieżek autoryzacji lub zatwierdzania produktów medycznych, warto przyjrzeć się czym EUA nie jest:
EUA nie jest oznaczeniem produktu eksperymentalnego poddawanego badaniu klinicznemu
Jeśli rozumiemy tylko jedną rzecz dotyczącą EUA, powinno być tak: EUA nie ma zastosowania do produktu poddawanego badaniu klinicznemu podlegającemu przepisom FDA lub innym wymaganiom prawnym.
EUA to także nie to samo, co rozszerzony dostęp (EAU), często nazywany dostępem „współczucia”, który dotyczy zapewnienia pacjentom cierpiącym na poważne, nieuleczalne choroby dostępu do produktów eksperymentalnych przed ich pełnym zatwierdzeniem.
Ta tabela z Prezentacja FDA-CDC 2020 podsumowuje różnice pomiędzy produktami przechodzącymi badania kliniczne, produktami udostępnianymi pacjentom w ramach rozszerzonego „współczującego” dostępu i produktami dopuszczonymi w ramach EUA:
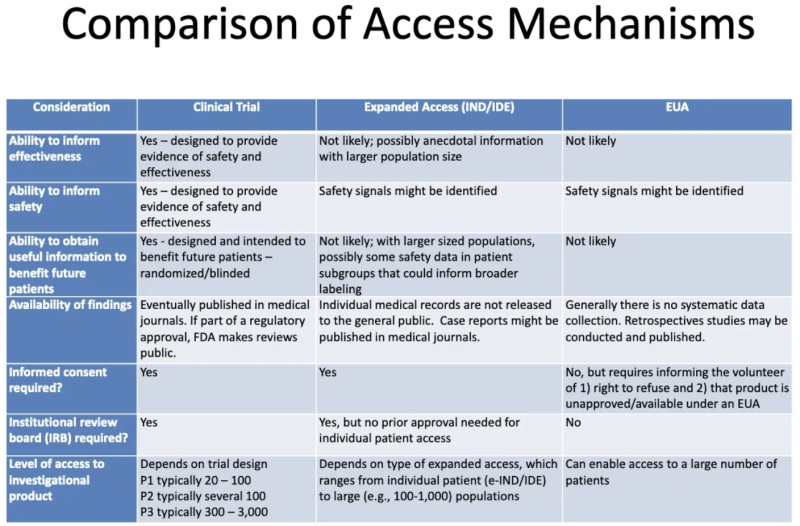
Oto, co ta tabela mówi nam o EUA:
- Proces przyznawania EUA nie generuje informacji o skuteczności produktu.
- Proces przyznawania uprawnień EUA nie ma na celu dostarczenia dowodów bezpieczeństwa lub skuteczności, ale mogą zostać zidentyfikowane sygnały dotyczące bezpieczeństwa.
- Jest mało prawdopodobne, że po przyznaniu produktowi EUA i podaniu go niektórym pacjentom, zostaną uzyskane jakiekolwiek przydatne informacje, które przyniosą korzyści przyszłym pacjentom.
- Nie ma systematycznego gromadzenia danych na temat skuteczności lub bezpieczeństwa EUA i żadne dane nie są publikowane w czasopismach medycznych w ramach procesu zatwierdzania przez organy regulacyjne.
- Nie jest wymagana świadoma zgoda, jednak pacjentów, którzy „zgłaszają się” na przyjęcie produktu, należy poinformować, że mogą odmówić i że produkt nie jest zatwierdzony/dostępny na mocy EUA.
- Nie jest wymagana żadna instytucjonalna komisja odwoławcza (IRB). [IRB to tablica, która ma chronić dobro ludzi biorących udział w badaniach klinicznych]
Aby jeszcze bardziej wyjaśnić, w jaki sposób EUA różni się od normalnego procesu zatwierdzania, w a 2009 Publikacja Instytutu Medycyny Akademii Narodowych, znajdujemy to stwierdzenie:
Należy pamiętać, że licencja EUA nie jest częścią ścieżki rozwoju; jest to całkowicie odrębna jednostka, używana wyłącznie w sytuacjach awaryjnych i nie będąca częścią procesu zatwierdzania leku. (s. 28)
Podsumowując:
Jest mało prawdopodobne, aby proces przyznawania EUA dla produktu generował jakiekolwiek dowody bezpieczeństwa lub skuteczności. Kiedy produkt otrzyma EUA i zostanie podany pacjentom, jest mało prawdopodobne, że zostaną uzyskane jakiekolwiek przydatne informacje, z których skorzystają przyszli pacjenci, ponieważ nie prowadzi się systematycznego gromadzenia danych na temat skuteczności i bezpieczeństwa.
Na podstawie wszystkich tych bardzo jasnych informacji uzyskanych od CDC/FDA i IMNA można śmiało stwierdzić, że wydawanie zezwoleń na użycie w sytuacjach awaryjnych to proces, który należy stosować bardzo rozważnie i wyłącznie w przypadku poważnych sytuacji awaryjnych.
Przyjrzyjmy się teraz, do jakich sytuacji awaryjnych zgodnie z prawem zaprojektowano EUA.
EAU jest przeznaczona do stosowania w sytuacjach awaryjnych związanych z bronią masowego rażenia
Przepisy zezwalające na opisany powyżej „mechanizm dostępu” EUA zostały opracowane na wypadek ekstremalnych, natychmiastowych sytuacji kryzysowych z udziałem broni masowego rażenia (BMR), zwanej także środkami CBRN (chemicznym, biologicznym, radiologicznym, nuklearnym).
Oto jak Agencja ds. Żywności i Leków: (FDA) opisuje swoje uprawnienia EUA:
Artykuł 564 ustawy FD&C (21 USC 360bbb–3) umożliwia FDA wzmocnienie ochrony zdrowia publicznego przed czynnikami biologicznymi, chemicznymi, nuklearnymi i radiologicznymi.
Dzięki temu uprawnieniu EUA FDA może pomóc w zapewnieniu możliwości zastosowania medycznych środków zaradczych w sytuacjach awaryjnych w celu diagnozowania, leczenia lub zapobiegania poważnym lub zagrażającym życiu chorobom lub stanom spowodowanym przez czynniki biologiczne, chemiczne, nuklearne lub radiologiczne, gdy nie ma odpowiednich, zatwierdzonych oraz dostępne alternatywy (wśród innych kryteriów).
Te uprawnienia EUA przyznano w 2004 r. w bardzo szczególnych okolicznościach związanych z gotowością na ataki agentów CBRJ.
Jak wyjaśniono w ustawie o zdrowiu Harvard Law,
Ostatecznie to wojna z terroryzmem doprowadziła do wydania zezwolenia na użycie w sytuacjach awaryjnych. Po wydarzeniach z 11 września 2001 r. i następujących po nich atakach pocztowych zawierających wąglika Kongres uchwalił Ustawa o projekcie Bioshield z 2004 r.
Połączenia rekord wskazuje, że Kongres skupił się konkretnie na zagrożeniu bioterroryzmem, a nie na przygotowaniach do naturalnie występującej pandemii.
Biorąc pod uwagę tak wąski rodzaj naprawdę ekstremalnej sytuacji awaryjnej obejmującej atak BMR, zrozumiałe jest, dlaczego „mechanizm dostępu” EUA nie wymaga dużego nadzoru regulacyjnego ani przestrzegania jakichkolwiek standardów produkcyjnych lub badań klinicznych.
Czego więc właściwie wymaga mechanizm dostępu do EUA?
3 kroki autoryzacji do użytku awaryjnego (EUA)
Aby produkt medyczny otrzymał EUA, muszą zajść trzy rzeczy:
- Sekretarz Bezpieczeństwa Wewnętrznego, Sekretarz Obrony lub Sekretarz Zdrowia i Opieki Społecznej muszą ustalić, czy istnieje sytuacja nadzwyczajna obejmująca atak lub groźbę ataku z użyciem środka CBRN lub chorobę wywołaną przez taki czynnik.
- Wydając EUA, FDA musi upewnić się, że spełnia cztery „kryteria ustawowe”.
- FDA musi „nałożyć pewne wymagane warunki” na EUA.
EUA Krok 1: Ogłoszenie stanu nadzwyczajnego CBRN
Deklaracja nadzwyczajna dla EUA jest odrębna i niezwiązana z żadnymi innymi deklaracjami nadzwyczajnymi, które mogą zostać wydane przez Prezydenta, Sekretarza HHS lub kogokolwiek innego. Musi zostać wydany specjalnie w celu aktywacji EUA i może zostać zakończony lub przedłużony niezależnie od jakiejkolwiek innej deklaracji nadzwyczajnej.
Oto co stanowi prawo EUA są cztery możliwe scenariusze aktywacji „mechanizmu dostępu” EUA:
- stwierdzenie przez Sekretarza Bezpieczeństwa Wewnętrznego, że ma miejsce sytuacja nadzwyczajna w kraju lub istnieje znaczne prawdopodobieństwo wystąpienia sytuacji awaryjnej w kraju, wiążącej się ze zwiększonym ryzykiem ataku z użyciem środka lub środków biologicznych, chemicznych, radiologicznych lub nuklearnych;
- stwierdzenie przez Sekretarza Obrony, że istnieje stan nadzwyczajny wojskowy lub istnieje poważne ryzyko wystąpienia stanu nadzwyczajnego wojskowego, wiążący się ze zwiększonym ryzykiem dla Zjednoczony Zjednoczone sił zbrojnych, w tym personelu działającego na mocy tytułu 10 lub tytułu 50, ataku z:
- czynnik lub czynniki biologiczne, chemiczne, radiologiczne lub nuklearne; Lub
- agent lub agentów, którzy mogą powodować lub są w inny sposób powiązani z bezpośrednim zagrożeniem życia i szczególnym ryzykiem dla United Zjednoczone wojsko;
- ustalenie przez Sekretarz [Zdrowia i Opieki Społecznej], że istnieje stan nadzwyczajny w zakresie zdrowia publicznego lub znaczny potencjał wystąpienia stanu nadzwyczajnego w zakresie zdrowia publicznego, który ma wpływ lub może w znaczący sposób wpłynąć na bezpieczeństwo narodowe lub zdrowie i bezpieczeństwo Zjednoczony Zjednoczone obywatele mieszkający za granicą, i które dotyczą czynnika lub czynników biologicznych, chemicznych, radiologicznych lub nuklearnych albo choroby lub stanu, który można przypisać takiemu czynnikowi lub czynnikom; Lub
- identyfikacji istotnego zagrożenia zgodnie z art. 319F–2 Ustawy Ustawa o publicznej służbie zdrowia [42 USC 247d–6b] wystarczający, aby mieć wpływ na bezpieczeństwo narodowe lub zdrowie i bezpieczeństwo Zjednoczony Zjednoczone obywateli mieszkających za granicą.
EUA Krok 2. Spełnienie kryteriów ustawowych
Kiedy jeden z sekretarzy zadeklaruje, że istnieje sytuacja nadzwyczajna uzasadniająca wydanie EUA, istnieją jeszcze cztery „kryteria ustawowe”, które muszą zostać spełnione, aby FDA wydała EUA. Oto jak FDA wyjaśnia te wymagania:
- Poważna lub zagrażająca życiu choroba lub stan
Aby FDA mogła wydać EUA, środek (czynniki) CBRN, o którym mowa w deklaracji EUA Sekretarza HHS, musi być w stanie spowodować poważną lub zagrażającą życiu chorobę lub stan.
- Dowód skuteczności
Produkty medyczne, które można uwzględnić w EUA, to te, które „mogą być skuteczne” w zapobieganiu, diagnozowaniu lub leczeniu poważnych lub zagrażających życiu chorób lub stanów, które mogą być spowodowane przez czynnik(-y) CBRN określony w oświadczeniu Sekretarza HHS awaria lub groźba sytuacji awaryjnej zgodnie z sekcją 564(b).
Standard „może być skuteczny” dla EUA zapewnia niższy poziom dowodów niż standard „skuteczności” stosowany przez FDA przy zatwierdzaniu produktów. FDA zamierza ocenić potencjalną skuteczność ewentualnego produktu EUA w każdym przypadku z osobna, stosując analizę ryzyka i korzyści, jak wyjaśniono poniżej.
[DODANO POgrubioną czcionkę]
- Analiza ryzyka i korzyści
Produkt może zostać uznany za EUA, jeśli Komisarz ustali, że znane i potencjalne korzyści produktu stosowanego do diagnozowania, zapobiegania lub leczenia zidentyfikowanej choroby lub stanu przewyższają znane i potencjalne ryzyko związane z produktem.
Przy ustalaniu, czy znane i potencjalne korzyści produktu przewyższają znane i potencjalne ryzyko, FDA zamierza patrzeć na podstawie całości dowodów naukowych, aby dokonać ogólnego określenia stosunku ryzyka do korzyści. Taki dowód, który mogłoby powstać z różnych źródeł, może zawierać (m.in.): wyniki badań klinicznych krajowych i zagranicznych, dane dotyczące skuteczności in vivo na modelach zwierzęcych oraz dane in vitro, dostępne do rozpatrzenia przez FDA. FDA oceni również jakość i ilość dostępne dowody, biorąc pod uwagę obecny stan wiedzy naukowej.
[DODANO POgrubioną czcionkę]
- Żadnych alternatyw
Aby FDA mogła wydać EUA, nie może istnieć odpowiednia, zatwierdzona i dostępna alternatywa dla produktu kandydującego do diagnozowania, zapobiegania lub leczenia choroby lub stanu. Potencjalny produkt alternatywny można uznać za „niedostępny”, jeżeli zapasy zatwierdzonego produktu alternatywnego są niewystarczające, aby w pełni zaspokoić zapotrzebowanie w sytuacjach nadzwyczajnych.
EUA Krok 3. Nałożenie wymaganych warunków
Kiedy już otrzymamy deklarację nadzwyczajną specyficzną dla EUA i kiedy FDA ustali, że produkt może być skuteczny i że wszelkie dostępne dowody wskazują, że korzyści z niego płynące przewyższają ryzyko, istnieje jeszcze jeden poziom powiązanych przepisów.
Oto jak Raport Congressional Research Service z 2018 r. na temat EUA wyjaśnia to:
FFDCA §564 nakazuje FDA nałożenie pewnych wymaganych warunków w EUA i dopuszcza dodatkowe, uznaniowe warunki, w stosownych przypadkach. Wymagane warunki różnią się w zależności od tego, czy licencja EUA dotyczy niezatwierdzonego produktu, czy niezatwierdzonego użycia zatwierdzonego produktu. W przypadku niezatwierdzonego produktu warunki stosowania muszą:
(1) zapewnić, że pracownicy służby zdrowia podający produkt otrzymają wymagane informacje;
(2) zapewnić, że osoby, którym podaje się produkt, otrzymały wymagane informacje;
(3) zapewnić monitorowanie i zgłaszanie zdarzeń niepożądanych związanych z produktem; I
(4) zapewniać prowadzenie rejestrów i raportowanie przez producenta.
Wnioski
Jak zauważono w tym artykule, FDA/CDC wyraźnie uznaje, że jest mało prawdopodobne, aby proces wydawania zezwolenia na użycie awaryjne (EUA) generował jakiekolwiek informacje na temat skuteczności lub bezpieczeństwa produktu. Kiedy spojrzymy na literę prawa regulującego EUA, zobaczymy, że jest to rzeczywiście słuszna ocena.
Prawo EUA nie narzuca żadnych standardów prawnych ani regulacyjnych, które mogłyby określić, czy produkt jest bezpieczny i skuteczny. Jedyne standardy dotyczą tego, czy FDA uważa, że produkt może być skuteczny i czy jego znane korzyści przewyższają znane szkody. Jeżeli nie są znane żadne szkody ani korzyści, ponieważ produkt nigdy nie przeszedł procesu zatwierdzania leku, FDA może w celu dokonania takiego ustalenia wykorzystać dowolne informacje lub standardy.
Z tego wszystkiego wynika, że firma, której produkt jest kandydatem do EUA, może próbować wykazać bezpieczeństwo i/lub skuteczność produktu w dowolny wybrany przez siebie sposób. Istnienie takiej próby (czy to badanie kliniczne, czy inny mechanizm gromadzenia danych) oraz sposób jej przeprowadzenia zależą od firmy. Żadne przepisy prawa EUA nie mają zastosowania do sposobu, w jaki firma projektuje, przeprowadza lub analizuje jakiekolwiek badania lub inne wybrane przez siebie mechanizmy gromadzenia danych.
W odniesieniu do produktów Covid oznacza to:
- Aby produkty Covid otrzymały EUA, nie były wymagane żadne dane dotyczące bezpieczeństwa ani skuteczności z badań klinicznych.
- Wszelkie badania kliniczne, o których mowa w procesie EUA, zostały przeprowadzone bez prawnie obowiązujących standardów regulacyjnych.
- Kiedy dowiadujemy się, że tym produktom brakuje skuteczności lub bezpieczeństwa, nie jest to zaskoczeniem. Jest to wysoce prawdopodobny wynik tego procesu.
- Nie ma danych z procesu EUA, na których można by oprzeć decyzje spoza EUA dotyczące bezpieczeństwa lub skuteczności produktu. Zatem jakiekolwiek użycie produktu poza EUA wymagałoby od początku przejścia przez proces prawnego zatwierdzania zwykłych produktów medycznych.
Więcej informacji na temat procesu zatwierdzania szczepionek na Covid tutaj.
Opublikowane ponownie od autora Zastępki
Opublikowane pod a Creative Commons Uznanie autorstwa 4.0 Licencja międzynarodowa
W przypadku przedruków ustaw link kanoniczny z powrotem na oryginał Instytut Brownstone Artykuł i autor.









