Ze wszystkich leków przeciwwirusowych na Covid-19, Paxlovid firmy Pfizer odniósł największy sukces. Nie ze względu na bezpieczeństwo i skuteczność, ale ze względu na zdolność do generowania przez firmę miliardowych zysków, mimo że jest w dużej mierze nieskuteczny dla większości ludzi.
W listopadzie 2021 r., zanim pojawiły się jakiekolwiek dane, administracja Bidena zobowiązała się do nabywczy 10 milionów kursów leczenia lekiem Paxlovid o wartości 5.3 miliarda dolarów do czasu uzyskania zezwolenia amerykańskiego organu regulacyjnego ds. leków.
Miesiąc później Paxlovid był udzielony zezwolenie na stosowanie w sytuacjach awaryjnych (EUA) wydane przez FDA do stosowania u dorosłych i dzieci w wieku 12 lat lub starszych.
Autoryzacja została oparta na dane z wczesnych prób wykazanie, że lek może zmniejszyć liczbę hospitalizacji lub liczbę zgonów (89% zmniejszenie ryzyka względnego, 6% zmniejszenie ryzyka bezwzględnego) u pacjentów wysokiego ryzyka, którzy nie byli szczepieni i nie byli wcześniej narażeni na Covid-19.
Problem polegał jednak na tym, że do tego czasu (grudzień 2021 r.) większość Amerykanów już taka była zaszczepione przeciwko Covid-19 lub miał wcześniej ekspozycja na wirusa, przez co wyniki badań są nieistotne dla większości ludzi.
Firma Pfizer musiała udowodnić, że jej lek może przynieść korzyści szerszemu rynkowi.
Producent rozpoczął badanie EPIC-SR, badające stosowanie Paxlovidu u osób nieszczepionych oraz osób zaszczepionych z co najmniej jednym czynnikiem ryzyka zachorowania na Covid-19 [clinicaltrials.gov].
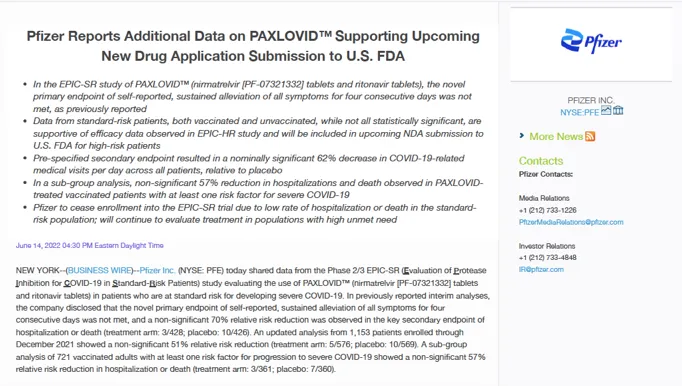
Jednak do lipca 2022 r. firma Pfizer zaprzestała przyjmowania uczestników „ze względu na bardzo niski wskaźnik hospitalizacji lub zgonów obserwowany w populacji pacjentów obciążonych standardowym ryzykiem”.
W komunikacie prasowym firma ogłosił że lek Paxlovid nie wpłynął na „nowy główny punkt końcowy, jakim było zgłaszane przez pacjentów trwałe złagodzenie wszystkich objawów przez cztery kolejne dni”.
Innymi słowy Paxlovid – połączenie nirmarelwir i rytonawir – nie wykazało istotnej różnicy w łagodzeniu objawów Covid-19 w porównaniu z placebo wśród pacjentów niehospitalizowanych.
Firma Pfizer stwierdziła, że trudno było znaleźć korzyści w populacji, w której wskaźnik hospitalizacji i zgonów z powodu Covid-19 był już niski.
Rok później, w sierpniu 2023 r., firma Pfizer po cichu opublikowała niekorzystne ustalenia ws clinicaltrials.gov, bez żadnych fanfar i uwagi mediów. W rzeczywistości media kontynuowały tę dyskusję promować korzyści płynące ze stosowania Paxlovidu dla szerszej publiczności.
Połączenia New York Timesna przykład podczas pandemii opublikował wiele artykułów na temat „siły leku Paxlovid”, zachęcając więcej osób do zażywania leku i krytykując jego niewystarczające użycie.

Jednocześnie firma Pfizer wzbudziła strach opinii publicznej, nadmiernie zawyżając ryzyko wystąpienia Covid-19, ułatwiając lekarzom przepisywanie leków takich jak Paxlovid w celu leczenia choroby. Czasami twierdzenia wprowadzały w błąd.
Na przykład firma Pfizer napisała na Twitterze, że 3 na 4 dorosłych Amerykanów jest w grupie „wysokiego ryzyka” ciężkiego przebiegu Covid-19, ale następnie przytoczyła w reklamie badanie, które nie potwierdzało tego twierdzenia – jak dotąd wprowadzający w błąd tweet obejrzano 11.6 milion razy.

„To niedorzeczne” – napisał na Twitterze Walid Gellad, profesor medycyny na Uniwersytecie w Pittsburghu. „Nie wiem, jak to jest legalne… 3 na 4 dorosłych nie jest w grupie wysokiego ryzyka ciężkiego przebiegu Covid-XNUMX”.
Nie powstrzymało to komisarza FDA Roberta Califfa od zamieszczenia w mediach społecznościowych informacji o zaletach leku Paxlovid.
He podsumowałem lek może zmniejszyć ryzyko rozwoju „długiego covida” w oparciu o słabe dowody, oraz Przyznał do „namawiania” do stosowania leku Paxlovid, ponieważ jego zdaniem „dowody były mocne”.
Califf zniósł krytykę za brak bezstronności jako szefa organu regulacyjnego, ale uzasadnił swoje działania „stanem zagrożenia zdrowia publicznego”.
Ekspertka ds. przepisów Jessica Adams stwierdziła, że to kiepska wymówka.
„Coś naprawdę jest nie tak z „przywództwem” w dziedzinie zdrowia publicznego, jeśli uważa się, że w sytuacji awaryjnej każdą normę można wyrzucić przez okno” – stwierdził Adams. „FDA nie nauczyła się niczego podczas pandemii i ustanawia straszne precedensy na wypadek przyszłych sytuacji kryzysowych”.
Do 2023 r. zwiększała się liczba doniesień o osobach, u których wystąpiły objawy „odbicia” po zastosowaniu leku Paxlovid. Władze nie mogły już tego zrobić roszczenie było to „rzadkie”.
Wysocy urzędnicy, tacy jak były dyrektor CDC Rochelle Walensky, były dyrektor NIAID Tony'ego Fauci'ego, Przewodniczący Joe Biden i pierwsza dama Jill biden wszyscy zgłosili nawrót objawów Covida po ukończeniu leczenia lekiem Paxlovid.

Kalif Zwolnione obawy dotyczące odbicia, twierdząc, że to tylko „odwrócenie uwagi”, ale badanie opublikowany in Sieć JAMA wykazali, że powrót objawów u osób z łagodną do umiarkowanej chorobą Covid-19 wynosił aż 25% po zażyciu leku Paxlovid.
W maju 2023 r. FDA przyznała lek Paxlovid pełna aprobata w leczeniu łagodnych i umiarkowanych zakażeń Covid-19 u dorosłych z wysokim ryzykiem rozwoju ciężkiej choroby (w tym u zaszczepionych dorosłych, pomimo braku danych wskazujących na korzyści w tej populacji).
W zeszłym tygodniu Paxlovid ponownie znalazł się w centrum uwagi po ostatecznym zakończeniu badania EPIC-SR opublikowany New England Journal of Medicine, prawie dwa lata po firmie Pfizer ogłosił daremność badania w lipcu 2022 r.
Niezależnie od wszystkich pozytywnych relacji w mediach i promocji leku Paxlovid przez urzędników zajmujących się zdrowiem publicznym i doradców rządowych, dowody są jasne.
Paxlovid, który teraz koszty 1,400 dolarów za 5-dniowy kurs przyniosło korzyści jedynie w bardzo rzadkiej populacji – to znaczy u niezaszczepionych osób, które nigdy nie miały kontaktu z wirusem i są w grupie wysokiego ryzyka poważnego zakażenia Covid-19.
Opublikowane ponownie od autora Zastępki
Opublikowane pod a Creative Commons Uznanie autorstwa 4.0 Licencja międzynarodowa
W przypadku przedruków ustaw link kanoniczny z powrotem na oryginał Instytut Brownstone Artykuł i autor.









